Вопрос 1 Параграф 27 ГДЗ Рудзитис 9 класс (2024) (Химия)
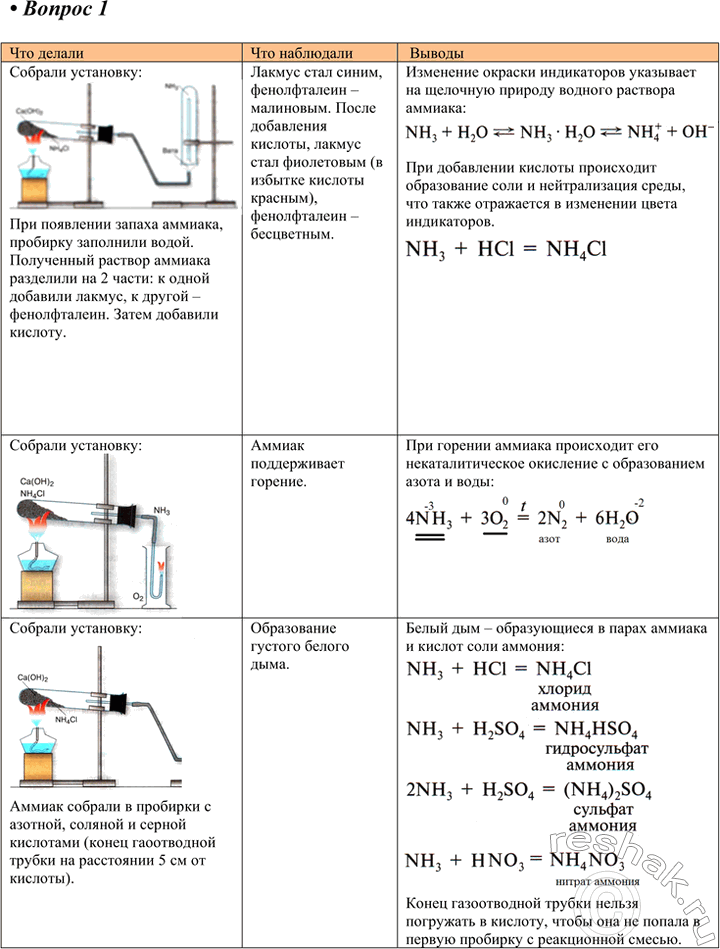
Практическая работа 4 Получение аммиака и изучение его свойств • Вспомните правила техники безопасности при работе в химическом кабинете 1. Получение аммиака и растворение его в воде 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объёмы кристаллического хлорида аммония NH4Cl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная).
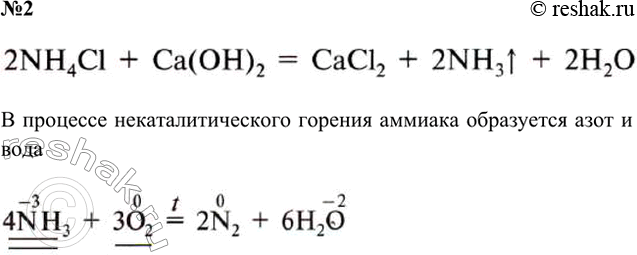

Ниже вариант решения задания из учебника Рудзитис, Фельдман 9 класс, Просвещение:
Практическая работа 4
Получение аммиака и изучение его свойств
• Вспомните правила техники безопасности при работе в химическом кабинете
1. Получение аммиака и растворение его в воде
1) В фарфоровой ступке хорошо перемешайте приблизительно равные объёмы кристаллического хлорида аммония NH4Cl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опушен в другую сухую пробирку, закреплённую в штативе горлышком вниз (рис. 21). Нагрейте смесь в пробирке.
2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку.
3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты.
• О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диссоциации?
• Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
2. Горение аммиака в кислороде
Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 22).
• Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
3. Взаимодействие аммиака с кислотами
В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты.
• Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций.
• Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
4. Отчёт о работе оформите в виде таблицы (см. § 18).
Ответ 2
№2
В процессе некаталитического горения аммиака образуется азот и вода
№3
NH3 + HCl > NH4Cl
2NH3 + H2SO4 > (NH4)2SO4
NH3 + HNO3 > NH4NO3
Образование белого дыма является следствием взаимодействия аммиака с кислотами и признаком образования соли аммония. Т.к. из-за поступающего в раствор газа (NH3), кислота может быть вытолкнута в трубку и попасть в первую колбу, то газоотводную трубку держат на некотором расстоянии от поверхности раствора кислоты.
