Часть ll Параграф 23 ГДЗ Рабочая тетрадь Габриелян Остроумов 8 класс (Химия)
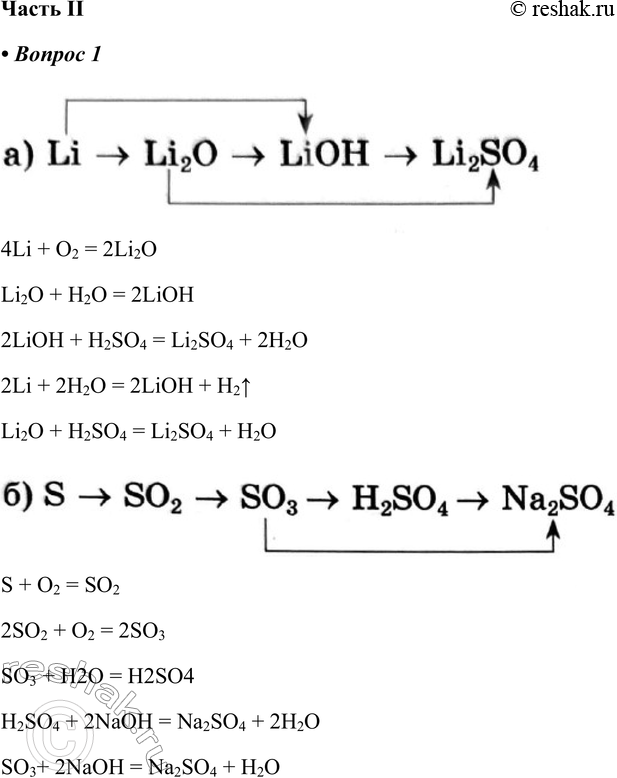
Часть II 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения 4Li + O2 = 2Li2O Li2O + H2O = 2LiOH 2LiOH + H2SO4 = Li2SO4 + 2H2O 2Li + 2H2O = 2LiOH + H2^ Li2O + H2SO4 = Li2SO4 + H2O S + O2 = SO2 2SO2 + O2 = 2SO3 SO3 + H2O = H2SO4 H2SO4 + 2NaOH = Na2SO4 + 2H2O SO3+ 2NaOH = Na2SO4 + H2O 2.


Ниже вариант решения задания из учебника Габриелян, Остроумов, Сладков 8 класс, Просвещение:
Часть II
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
4Li + O2 = 2Li2O
Li2O + H2O = 2LiOH
2LiOH + H2SO4 = Li2SO4 + 2H2O
2Li + 2H2O = 2LiOH + H2^
Li2O + H2SO4 = Li2SO4 + H2O
S + O2 = SO2
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
H2SO4 + 2NaOH = Na2SO4 + 2H2O
SO3+ 2NaOH = Na2SO4 + H2O
2. В 200 мл воды растворили 124 г оксида натрия. Найдите массовую долю и количество вещества щёлочи в полученном растворе.
Дано:
V(H2O)=200 мл
m(Na2O)=124 г
M(Na2O)= 62 г/моль
M(NaOH)= 40 г/моль
Na2O + H2O = 2NaOH
n(Na2O)=m/M=124/ 62 =2 (моль)
По уравнению реакции:
Na2O NaOH
2 моль x моль
1 молекула 2 молекулы
x =n(NaOH)= 2·2/1=4 (моль)
m(NaOH)= n· M=4· 40=160 (г)
w(H2O) = 1 г/мл > 200 мл = 200 г
m(раствора)= m(H2O)+ m(Na2O)=200 + 124 = 324 (г)
w(NaOH)= m(NaOH)/ m(раствора)=160/324 = 0,4938 = 49,38%
Ответ. 4 моль, 49,38%.
3. В 250 мл воды растворили 240 г оксида серы(VІ). Рассчитайте массовую долю и количество кислоты в полученном растворе.
Дано:
V(H2O)=250 мл
m(SO3)=240 г
M(SO3)= 80 г/моль
M(H2SO4)= 98 г/моль
SO3+ H2O = H2SO4
n(SO3)=m/M=240/ 80 =3 (моль)
По уравнению реакции:
SO3 H2SO4
3 моль x моль
1 молекула 1 молекула
x =n(H2SO4)= 3·1/1=3 (моль)
m(H2SO4)= n· M=3· 98= 294 (г)
w(H2O) = 1 г/мл > 250 мл = 250 г
m(раствора)= m(H2O)+ m(SO3)=250 + 240 = 490 (г)
w(NaOH)= m(NaOH)/ m(раствора)=294/ 490= 0,6 = 60%
Ответ. 3 моль, 60%.
4. Оксид кремния будет взаимодействовать с веществами:
1) Н2О
2) СаО
3) КОН
4) НСl
5) CuSO4
Запишите уравнения реакций.
Оксид кремния (IV) SiO2 – кислотный оксид, нерастворимый в воде, поэтому он будет взаимодействовать с основными оксидами и основаниями:
Ответ. 23.
Уравнения реакций:
SiO2 + CaO = CaSiO3
SiO2 + 2KOH = K2SiO3
5. Оксид калия будет взаимодействовать с веществами:
1) Н2О
2) СаО
3) NaOH
4) HNO3
5) NO
Запишите уравнения реакций.
Оксид калия K2O – основный оксид, растворимый в воде, поэтому он будет взаимодействовать с кислотами и водой:
Ответ. 14.
Уравнения реакций:
K2O + H2O = 2KOH
K2O + 2HNO3 = 2 KNO3 + H2O
6. Оксид хрома(VІ) образован металлом, но не относится к основным оксидам, так как ему соответствует хромовая кислота. Запишите уравнения реакций, характеризующих свойства этого оксида.
CrO3 + H2O = H2CrO4
CrO3 + K2O = K2CrO4
CrO3 + 2KOH = K2CrO4 + H2O
