(продоложение) Часть ll Параграф 18 ГДЗ Рабочая тетрадь Габриелян Остроумов 9 класс (Химия)
Часть II 1. Составьте уравнения реакций, соответствующих следующим превращениям: NaNO3 - > NaNO2 - > HNO2 - > NH4NO2 - >
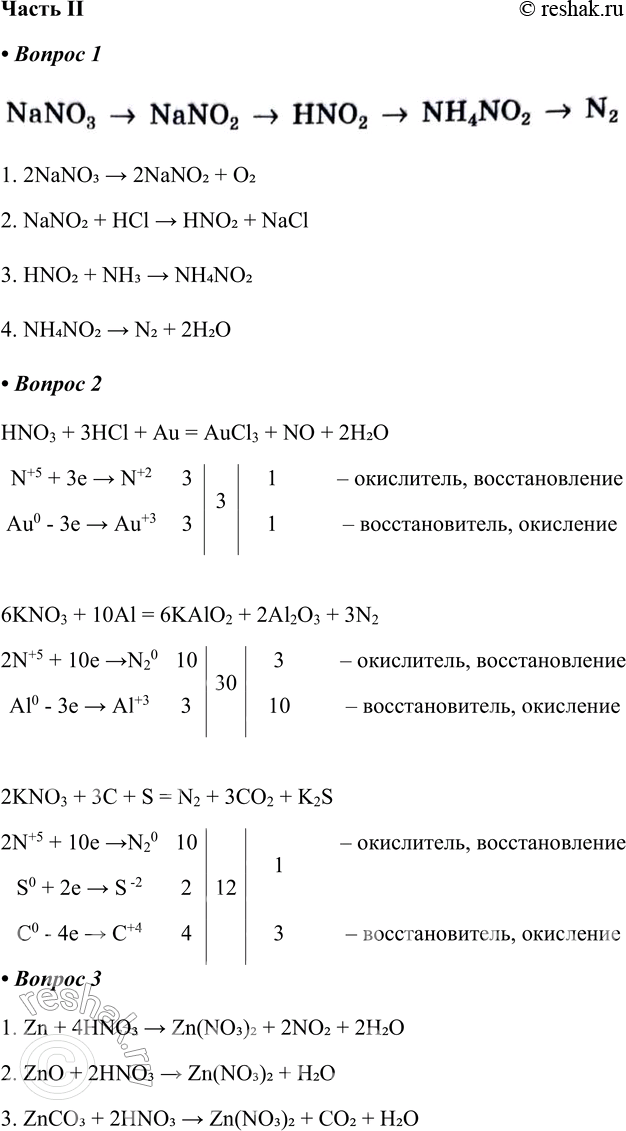

Ниже вариант решения задания из учебника Габриелян, Остроумов, Сладков 9 класс, Просвещение:
Часть II
1. Составьте уравнения реакций, соответствующих следующим превращениям:
NaNO3 - > NaNO2 - > HNO2 - > NH4NO2 - > N2
1. 2NaNO3 > 2NaNO2 + O2
2. NaNO2 + HCl > HNO2 + NaCl
3. HNO2 + NH3 > NH4NO2
4. NH4NO2 > N2 + 2H2O
2. Расставьте коэффициенты в схемах реакций с помощью метода электронного баланса.
a) HNO3 + НСl + Au - > AuCl3 + NO +
б) KNOg + Al KA102 + A12O3 + N2
в) KNO3 + C + S - > N2 + CO2 + K2S
3. Запишите три уравнения реакций получения нитрата цинка.
1. Zn + 4HNO3 > Zn(NO3)2 + 2NO2 + 2H2O
2. ZnO + 2HNO3 > Zn(NO3)2 + H2O
3. ZnCO3 + 2HNO3 > Zn(NO3)2 + CO2 + H2O
4. Для определения качественного состава неизвестной соли учащимся выдали белое кристаллическое вещество, хорошо растворимое в воде, известное как пекарский порошок. Часть выданной соли смешали с твёрдой щёлочью и смесь нагрели. При этом выделился газ с резким запахом. Другую часть соли растворили в воде и к полученному раствору прилили раствор кислоты. Смесь «вскипела», так как в результате реакции выделился газ. Определите химическую формулу и название неизвестной соли. Составьте уравнения двух реакций, которые были проведены для распознавания.
Белое кристаллическое вещество, хорошо растворимое в воде, известное как «пекарский порошок» – (NH4)2CO3
Газ с резким запахом – NH3
Газ, выделившийся при «вскипании» – CO2
(NH4)2CO3 + 2KOH > K2CO3 + 2NH3 + 2H2O
(NH4)2CO3 + 2HCl > 2NH4Cl + H2O + CO2
5. Для нейтрализации 50 мл раствора азотной кислоты (р = 1,115 г/мл) потребовалось 63,8 мл 10%-ного раствора гидроксида натрия (р = 1,11 г/мл). Определите массовую долю кислоты в исходном растворе.
6. При разложении 66,2 мг нитрата металла в степени окисления +2 образовалось 44,6 мг его оксида. Установите формулу нитрата.
