Часть l Параграф 19 ГДЗ Рабочая тетрадь Габриелян Остроумов 9 класс (Химия)
§ 19. Фосфор и его соединения Часть I 1. Заполните схему «Строение атома фосфора и его окислительно-восстановительные свойства». ЛИ» Строение атома фосфора и его окислительно-восстановительные свойства 2.



Ниже вариант решения задания из учебника Габриелян, Остроумов, Сладков 9 класс, Просвещение:
§ 19. Фосфор и его соединения
Часть I
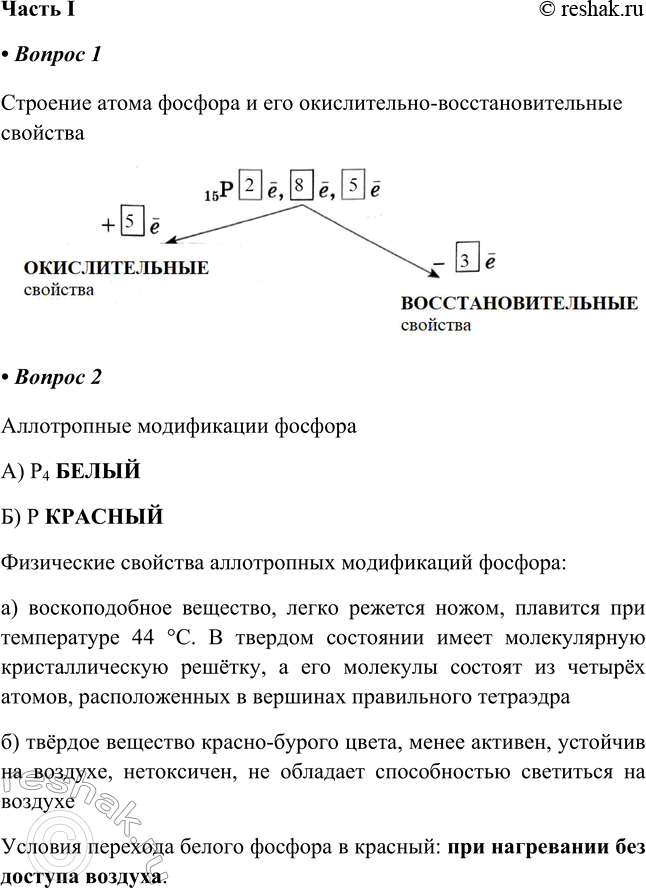
1. Заполните схему «Строение атома фосфора и его окислительно-восстановительные свойства».
ЛИ»
Строение атома фосфора и его окислительно-восстановительные свойства
2. Заполните схему.
Аллотропные модификации фосфора
Физические свойства аллотропных модификаций фосфора:
Условия перехода белого фосфора в красный:
Аллотропные модификации фосфора
А) P4 БЕЛЫЙ
Б) P КРАСНЫЙ
Физические свойства аллотропных модификаций фосфора:
а) воскоподобное вещество, легко режется ножом, плавится при температуре 44 °С. В твердом состоянии имеет молекулярную кристаллическую решётку, а его молекулы состоят из четырёх атомов, расположенных в вершинах правильного тетраэдра
б) твёрдое вещество красно-бурого цвета, менее активен, устойчив на воздухе, нетоксичен, не обладает способностью светиться на воздухе
Условия перехода белого фосфора в красный: при нагревании без доступа воздуха.
3. Химические свойства фосфора.
1) _ свойства
а) Реагирует с кислородом:
Р + Щ2
б) Реагирует с галогенами:
в) Реагирует со сложными веществами:
Р + HNO3 = __________ + __________ + __________
Составьте электронный баланс, укажите окислитель и восстановитель, процессы окисления и восстановления.
2) _ свойства
Реагирует с металлами:
Р + Mg _____
Продукты взаимодействия — _
Фосфиды щелочных и щелочноземельных металлов легко разлагаются водой (а), при этом образуется
Оксиды фосфора.
Продукты взаимодействия – ФОСФИДЫ
Фосфиды щелочных и щелочноземельных металлов легко разлагаются водой (а), при этом образуется ФОСФИН (б):
А) Na3P, Mg3P2
Б) Na3P + 3H2O > 3NaOH + PH3
Mg3P2 + 6H2O > 3Mg(OH)2 + 2PH3
4. а) _ — оксид фосфора(ІІІ), ему соответствует __ кислота
б) _ — оксид фосфора(III), ему соответствует ___ кислота _____
Оксиды фосфора.
а) P2O3 – оксид фосфора(III), ему соответствует фосфористая кислота H3PO3
б) P2O5 – оксид фосфора(V), ему соответствует фосфорная кислота H3PO4
5. Физические свойства фосфорной кислоты:
Физические свойства фосфорной кислоты: твердое белое вещество. Она настолько гигроскопична, что при непродолжительном хранении на воздухе её кристаллы расплываются и превращаются в вязкую жидкость.
6. Химические свойства фосфорной кислоты.
1) Как слабая трёхосновная кислота Н3РО4 диссонирует ступенчато в три стадии и образует три ряда солей при взаимодействии со щелочами (напишите полные и сокращённые ионные
уравнения)
а) Н3РО4 + NaOH (1 моль) =
б) Н3РО4 + NaOH (2 моль) =
в) Н3РО4 + NaOH (3 моль) =
2) Взаимодействует с солями по правилу Бертолле:
Н3РО4 + AgNO3 = _____________ + ____________
В результате образуется осадок __ цвета. Это качественная реакция на фосфат-ионы РО4~.
3) Взаимодействует с оксидами металлов:
Н3РО4 + К2О = _____________ + ___________
А) H3PO4 + NaOH (1 моль) > NaH2PO4 + H2O
3H+ + PO43- + Na+ + OH- > Na+ + H2PO4- + H2O
3H+ + PO43- + OH- > H2PO4- + H2O
Б) H3PO4 + 2NaOH (2 моль) > Na2HPO4 + 2H2O
3H+ + PO43- + 2Na+ + 2OH- > 2Na+ + HPO42- + 2H2O
3H+ + PO43- + 2OH- > HPO42- + 2H2O
В) H3PO4 + 3NaOH (3 моль) > Na3PO4 + 3H2O
3H+ + PO43- + 3Na+ + 3OH- > 3Na+ + PO43- + 3H2O
H+ + OH- > H2O
Взаимодействует с солями по правилу Бертолле:
H3PO4 + 3AgNO3 > Ag3PO4v + 3HNO3
3H+ + PO43- + 3Ag+ + 3NO3- > Ag3PO4v + 3H+ + 3NO3-
PO43- + 3Ag+ > Ag3PO4v
В результате образуется осадок: желтого цвета. Это качественная реакция на фосфат-ионы.
Взаимодействует с оксидами металлов:
2H3PO4 + 3K2O > 2K3PO4 + 3H2O
6H+ + 2PO43- + 3K2O > 6K+ + 2PO43- + 3H2O
6H+ +3K2O > 6K+ + 3H2O
7. Получение фосфорной кислоты в промышленности.
а) Получение разбавленной фосфорной кислоты из фосфатов:
б) Получение концентрированной фосфорной кислоты в результате последовательных превращений:
Р - > Р2О5 - > Н3РО4
4P + 5O2 > 2P2O5
P2O5 + 3H2O > 2H3PO4
