Часть ll Параграф 6 ГДЗ Рабочая тетрадь Габриелян Остроумов 9 класс (Химия)
Часть II 1. Запишите уравнения реакций, соответствующих следующим превращениям: FeS - > SO2 - > SO3 - > H2SO4(paзб.) - >
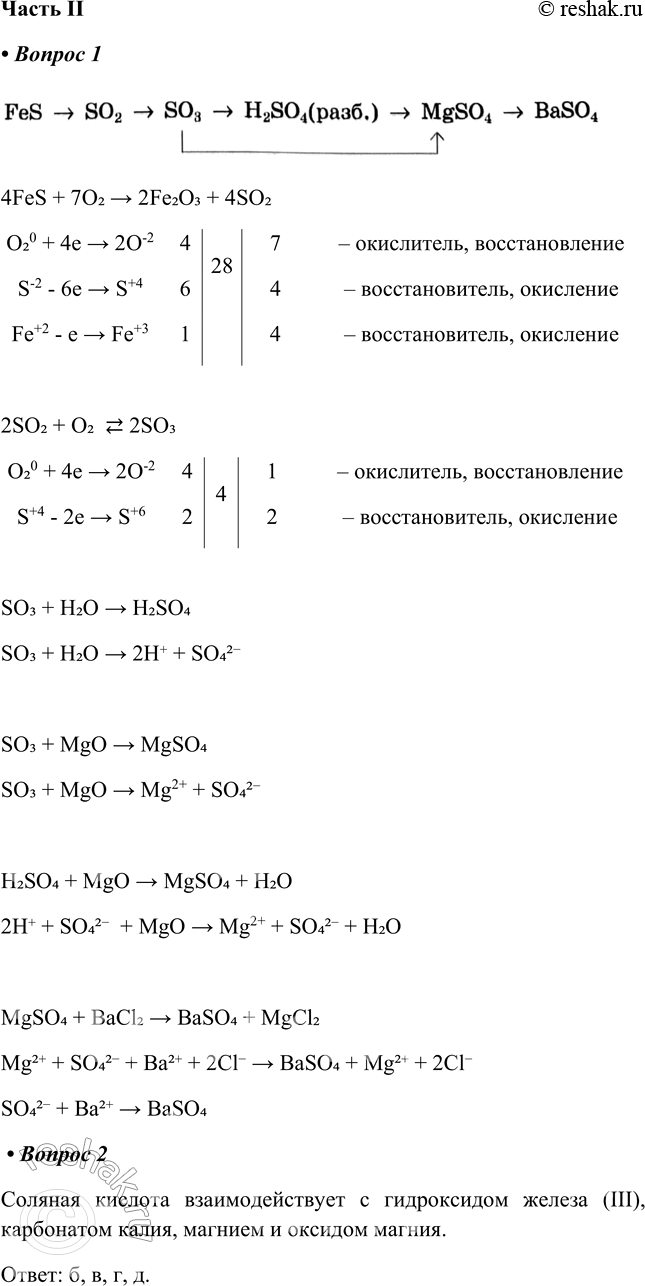


Ниже вариант решения задания из учебника Габриелян, Остроумов, Сладков 9 класс, Просвещение:
Часть II
1. Запишите уравнения реакций, соответствующих следующим превращениям:
FeS - > SO2 - > SO3 - > H2SO4(paзб.) - > MgSO4 - > BaSO4
Для окислительно-восстановительных реакций напишите электронный баланс, а для реакций с участием электролитов — полные и сокращённые ионные уравнения.
2. Соляная кислота взаимодействует со следующими веществами из перечня:
а) оксид фосфора(V)
б) гидроксид железа(III)
в) карбонат калия
г) магний
д) оксид магния
е) нитрат магния
ж) медь
Запишите уравнения реакций в молекулярной и ионной форме. Окислительно-восстановительные реакции рассмотрите с позиций окисления—восстановления.
Соляная кислота взаимодействует с гидроксидом железа (III), карбонатом калия, магнием и оксидом магния.
Ответ: б, в, г, д.
3. Установите соответствие между ионным уравнением реакции и реагентами.
ИОННОЕ УРАВНЕНИЕ
А) CO- + 2Н+ = СО2 + Н2О
Б) Сl + Ag+ = AgCl
РЕАГЕНТЫ
1) Agl + НС1
2) AgNO3 + AICI3
3) CaCO3 + HC1
4) (NH4)2CO3 + HNO3
5) NH4HCO3 + HC1
4. Расставьте коэффициенты в схеме реакции с помощью метода электронного баланса, укажите окислитель и восстановитель.
Zn + H2SO4 — > ZnSO4- H2S + Н2О
5. Запишите уравнения реакций разложения: а) сернистой кислоты; б) угольной кислоты; в) кремниевой кислоты; г) азотной кислоты.
К окислительно-восстановительным реакциям относится реакция разложения _
Рассмотрите её с позиций окисления—восстановления.
а) H2SO3 > H2O + SO2^
б) H2CO3 > H2O + CO2^
в) H2SiO3 > H2O + SiO2v
г) 4HNO3 > 2H2O + 4NO2^ + O2^
К окислительно-восстановительным реакциям относится реакция разложения азотной кислоты.
6. Найдите объём выделившегося газообразного продукта (н. у.), полученного взаимодействием 50 мг мрамора, содержащего 20 % примесей, с азотной кислотой. Какая масса 15%-ного раствора азотной кислоты потребовалась для реакции?
